- 小剂量多次注射链脲佐菌素建立糖尿病早期视网膜病变动物模型
视网膜病变(diabeticretinopathy,DR)是糖尿病患者造成视力损伤甚至失明的主要原因。其病理机制尚未完全阐明。长期以来,人们对DR的实验研究大多集中在糖尿病长期病程后视网膜的血管变化上,对早期视网膜神经组织功能及形态变化研究较少。中国医学科学院医学实验动物研究所比较医学研究中心神经退行性疾病实验室采用小剂量多次注射方法复制了链脲佐菌素(STZ)诱导糖尿病大鼠早期视网膜病变动物模型,动态观察糖尿病大鼠在建模后1至10周视网膜神经细胞的形态变化,为DR的研究提供参考。文章在2016年《中国实验动物学报》。
模型制备
雄性SPF级SD大鼠,体重180~ 210g,禁食12h后腹腔注射STZ 30mg/ kg,连续注射5d。最后一次注射3d后监测尾静脉血糖,空腹血糖 16.5 mmol/L 以上, 尿量及饮水明显增多者视为糖尿病模型成立。
结果
大鼠成模后 2周开始出现饮水、饮食增多、尿量明显增加。体重逐渐减轻,精神萎靡,蜷缩弓背,毛色枯黄,尾部苍白温度降低。部分动物在造模后2个月眼底开始变浑浊,到安乐之日有3只动物的眼底变为白色(图1)。
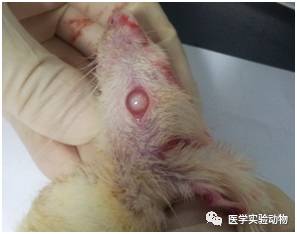
图1 造模后三个月动物晶状体变浑浊
H.E染色观察显示:对照组大鼠视网膜各层细胞排列规则,结构清晰(图2A)。糖尿病大鼠视网膜组织变薄,神经节细胞数量减少(图2B)。
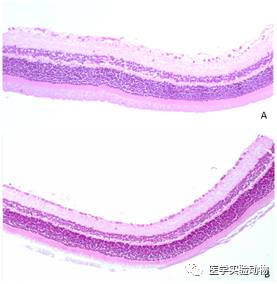
图2 STZ诱导糖尿病大鼠视网膜病变(HE染色)
注: A: 正常对照组(100x);B: 造模后三个月
免疫组化染色结果显示:对照组大鼠视网膜GFAP阳性细胞主要分布在节细胞层和神经纤维层(图3A),糖尿病组大鼠GFAP阳性细胞呈不连续散在分布,阳性细胞数明显减少(图3B)。对照组S100阳性细胞主要分布在内、界膜层、外丛状层、内核层。模型组S100阳性细胞表达部位与对照组相同,阳性细胞数未见明显改变(图3C,D)。
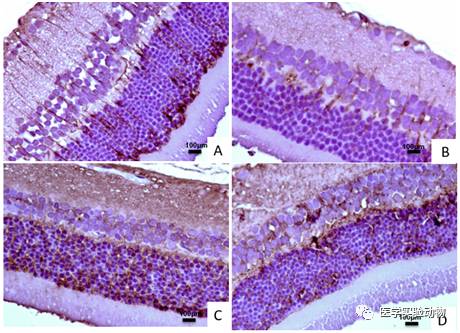
图3 STZ诱导糖尿病SD大鼠视网膜病变(免疫组化染色, bar=100µm)
消化铺片结果显示对照组大鼠视网膜血管管径均匀一致,分支自然流畅呈“树枝状”,周细胞、内皮细胞分布规则均匀(图4A)。模型组大鼠内皮细胞增生,细胞核边缘卷曲,核中央细长,两端膨大、核肥胖等形态各异;毛细血管膨大,细胞凋亡核固缩、深染(图4B,C,D)。
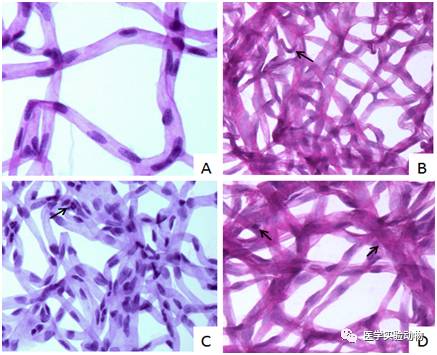
图 4 STZ诱导糖尿病SD大鼠视网膜病变消化铺片结果
结论
使用小剂量多次注射STZ建立糖尿病大鼠DR模型,与单次大剂量造模方法相比,不仅造模成功率高,视网膜和微血管的形态学及超微结构变化出现得更早,为DR早期病变的发病机理、药效学等的研究提供了可供选择的研究工具。
引用文章
朱华;李彦红;徐艳峰;徐玉环;许庆刚;尹红霞;秦川.小剂量多次注射链脲佐菌素建立糖尿病早期视网膜病变动物模型. 中国实验动物学报,2016,24(5):487-493
北京康蓝中实医学检验技术有限公司
中国医学科学院医学实验动物研究所实验病理分析平台的技术资产对外转化,组建了北京康蓝中实医学检验技术有限公司。该平台是国内最早开展实验动物毒性病理诊断的部门,于1994年经国家科委批准成立了国家实验动物病理检测中心,通过了国家实验室合格评定委员会CNAS认证。平台已与国内十几家研究机构建立了长期合作关系,为其提供实验动物病理诊断、特殊染色等病理技术服务,实验动物血液学、生理生化分析服务等。
公司目前现拥有工作人员12名,其中包括从中国医学科学院医学实验动物研究所引进的病理学家4位,高级职称的专业技术人员5位,专门从事实验动物的病理第三方检验和诊断服务,主要业务包括实验病理诊断、病理及病理生理分析等技术服务。
- 版权所有 © 北京康蓝生物技术有限公司 地址:北京市北京经济技术开发区科创五街38号院3号楼12层1211B 电话:17710201687
- 京公网安备110105013330 京ICP备09059146号-1

